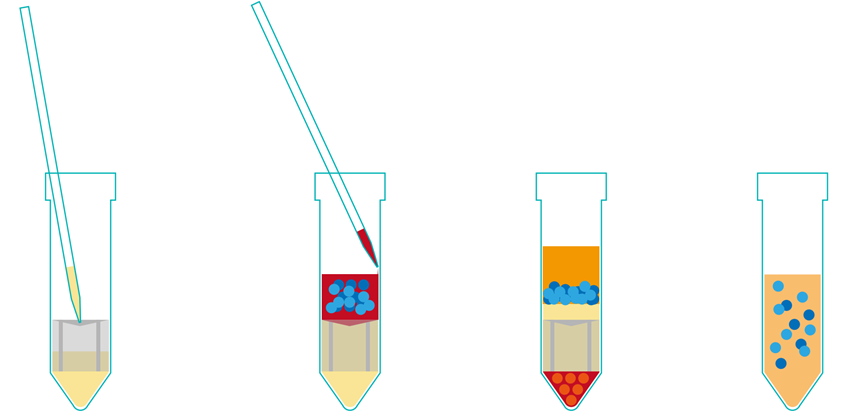
加入細胞分離液 加入樣本 離心后分層 收集富集細胞、重復洗滌
1) 將抗凝樣本(血或骨髓,如果需要可以用生理鹽水稀釋)延管壁緩慢倒入或用移液管延管壁緩慢加入到分離管中:如果用15ml的分離管建議使用4-9ml樣本;如果用50ml的分離管建議使用13-30ml樣本。
2) 室溫下離心,離心力為1200 x g需要10分鐘,關閉離心機。對于放置24h以上的樣品,建議離心時間加長。
3) 離心后液體分離情況(從上到下)為:a血漿 ;b富集的細胞部分(中間相包含淋巴細胞/PBMCs細胞);c分離液;d嵌套;e沉淀(紅細胞和粒細胞)。采集或丟棄富集細胞所在層以上5到10mm的血漿層有助于防止富集細胞被血小板再次污染。
4) 收獲富集細胞(淋巴細胞/PBMCs細胞),將分離管中上清倒入另一干凈離心管中,分離管中的嵌套能有效避免富集細胞被紅細胞和粒細胞再次污染。建議不要將分離管倒置2s以上。
5) 用磷酸鹽緩沖液(PBS)洗滌富集細胞(淋巴細胞/PBMCs細胞),然后在250 x g離心力下離心10分鐘。
6) 按步驟5重復洗滌2次,最后用5ml PBS緩沖液重新懸浮細胞。
注意事項/ Cautions
1) 本產品應由經過專業培訓的人員操作,并遵守良好的實驗室規范。
2) 請勿重復使用分離管。
3) 由于各品牌離心機的性能不同,地區溫度環境差異,可能影響分離效果,用戶可以調節離心轉速和離心的時間,摸索最佳的分離條件(具體分離條件由各實驗室自定)。
4) 可用于人類外周血、骨髓和臍帶血樣本。它不適用于白細胞分離樣本、血沉棕黃層樣本或超過48小時的樣本。
5) 離心后,細胞可能聚集在富集層以上的分離管的管壁上。這種聚合是正常的,受樣本質量、樣本放置時間和抗凝劑類型的影響。此聚合與分離管的使用無關。細胞可以通過使用移液管尖端刮管壁的一側來清除。
6) 處理任何生物來源的標本,使用采血針、采血管系列、相關儀器等一定要注意按嚴格的操作規程使用。請把標本當成可能感染 HIV、HBV、HCV等傳染病的危險物質處理。為避免操作時感染的危險,請使用一次性手套。